“高トリグリセリド血症性急性膵炎(HTG-AP)”へのトリグリセライド薬物治療に関して意外とクリアなエビデンスは無いのかもしれない
Clinical Review State of the Art Review
Management of hypertriglyceridemia
BMJ 2020; 371
doi: https://doi.org/10.1136/bmj.m3109 (Published 12 October 2020)
https://www.bmj.com/content/371/bmj.m3109.short?rss=1
高トリグリセリド血症はかなり一般的な臨床状態であるが、その影響と管理についてはかなりの議論が続いている。
高トリグリセリド血症性急性膵炎(HTG-AP)の診断は比較的簡単なように見えるが、臨床家はかなりの数の難問に直面している。
- 高トリグリセリド血症は急性膵炎の原因なのか、それとも結果なのか?
- 以前の非空腹時血清トリグリセリド値は高トリグリセリド血症の診断や将来のリスク評価に有効なのか?
- 患者の高トリグリセリド血症の原因は何か:原発性の遺伝子異常か、それとも糖尿病とエストロゲンの使用による二次的なものか?
- 遺伝子検査は有益か?
- 高トリグリセリド血症に対する最適な治療計画は何か?
- 高トリグリセリド血症はアテローム性動脈硬化性心血管病(ASCVD)の長期的なリスクを増加させますか?
- 特に「ケトジェニック」な食事に対する嗜好の観点から、推奨されるべき最適な食事は何ですか?ス
- タチン、フィブラート、オメガ3脂肪酸、ナイアシン、またはそれらの組み合わせのいずれの薬物治療が最も効果的でしょうか?
Metabolism of triglyceride-rich lipoproteins (TGRL)
2つの主要 l TGRLである chylomicrons (CHYLO) と very low density lipoproteins (VLDL) は各々腸管、肝臓で分泌される。脂肪組織や骨格筋で主に発現されているlipoprotein lipase (LPL) で加水分解され、これら組織に遊離脂肪酸として流し込み、カイロミクロンレムナント(CR)、VLDLレムナント (VLDLr)やintermediate density lipoproteins (IDL)へ流れる。
CR、VLDLr、IDLは LDL receptor related proteins (LRP)で除去されるか、さらにはhepatic lipase (HL)で加水分解されLDL分子形成に導かれる。
LDLと同様、RLPも血管内へ取り込まれ、血管炎症や動脈硬化原性に働く
LPL活性のpositiveとnegativeのinfluencerとしての働きが示されているが、インスリンは脂肪組織hormone sensitive lipase (HSL)を抑制する役割がある
Refer to table 2 for details of these and other key molecules involved in metabolism of TGRLs.
ANGPTL 3/4=angiopoetin-like proteins 3 and 4; Apo=apolipoprotein; A-V=apolipoprotein A-V; C=apolipoprotein C; CE=cholesteryl ester; E=apolipoprotein E; GPIHBP1=glycosylphosphatidylinositol-anchored high density lipoprotein binding protein-1; LMF=lipase maturation factor; TG=triglycerides
高TG血漿の原因 : Box2 参照
管理:ここでは
Management of severe hypertriglyceridemia in patients with acute hypertriglyceridemic pancreatitis
減量
食事変容
運動
アルコール
薬物治療
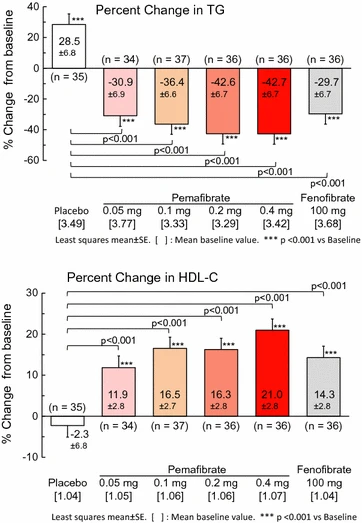
血清トリグリセリドが500mg / dLを超えると膵炎のリスクが高まるため、ほとんどのガイドラインでは、このリスクを軽減するためにフィブラート、オメガ3脂肪酸、またはナイアシンによる治療を推奨しています。ただし、これらの推奨事項は主に観察研究に基づいています。4万人以上の患者を対象とした7件のフィブラート試験のメタアナリシスでは、プラセボと比較して膵炎のリスクの低下を示すことができませんでした(リスク比1.39、95%信頼区間1.00〜1.95)。ただし、これらの試験のベースライントリグリセリド濃度は118〜187 mg / dLの範囲であったため、より重度の高トリグリセリド血症の人々におけるHTG-APのリスクは考慮されていません。興味深いことに、同じメタアナリシスは、スタチン療法による膵炎のリスクの低下を示しました(リスク比0.77、0.62から0.97)。これは、スタチン治療による胆汁コレステロール濃度の低下に関連している可能性がありますが、フィブラートは胆汁コレステロール濃度と胆石のリスクを高めます。しかし、重度の高トリグリセリド血症の患者におけるフィブラートのトリグリセリド低下効果は、膵炎のリスクのより大きな決定要因である可能性が高く、これらの状況下での使用を正当化します。同様に、オメガ-3脂肪酸療法またはナイアシンによる膵炎のリスクの低下を示した臨床試験はありませんが、前者はおそらくその抗炎症効果のために、急性膵炎のいくつかの転帰を改善することが示されています。ただし、血清トリグリセリドを30〜50%減少させることが示されているため、HTG-APのリスクを減少させるという仮定は妥当です。
<hr>
以下の薬剤がどのような臨床的役割を果たすか?いまのところ、日本ローカルな薬剤に過ぎないのでエビデンス構築困難とは思うが・・・
フィブラート系新薬パルモディア(一般名:ペマフィブラート)
Pemafibrate (K-877), a novel selective peroxisome proliferator-activated receptor alpha modulator for management of atherogenic dyslipidaemia
https://cardiab.biomedcentral.com/articles/10.1186/s12933-017-0602-y
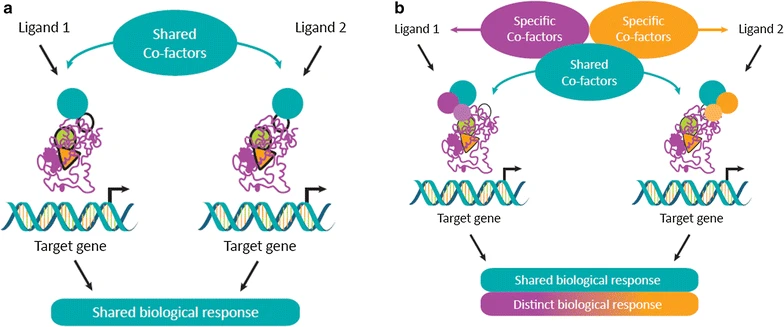
核内受容体の選択的調節がSPPARMの概念をどのように支えているかを示す模式図。異なるリガンドの核内受容体への結合は、異なる構造変化を誘導し、それが補因子の親和性に影響を与えます。異なるリガンドは補因子を共有し、結果として生物学的応答を共有する(a)が、補因子と受容体の結合プロファイルには明確な違いがある(b)かもしれない。このように、リガンドのユニークな受容体-界面活性剤結合プロファイルは、受容体結合の特異性と効力を決定する重要な要素であり、その結果、遺伝子および組織の選択的効果を調節します。