本来は
このコホート研究の結果は、SGLT2iとSU薬の比較による全死亡リスクの実データを提供し、2型糖尿病患者における高血糖治療選択の指針になると思われる
という報告
だが、以下の表の後半部分 SGLT2i with メトホルミン vs SGLT2i without メトホルミンの比較が気になる
 |
| Per-Protocol Hazard Ratios(HRs) and Event Rate Reduction for All-Cause Mortality |
メトホルミンは、ビグアナイド系化合物で、糖新生を阻害することにより肝性糖産生を抑制する。メトホルミンの作用機序はSGLT2阻害薬とは異なるが、両薬剤は互いに作用を補完し合い、膵β細胞の標的化、体重増加、重大な安全性リスクはない。 14件の研究のシステマティックレビューでは、SGLT2阻害剤(ダパグリフロジン)とメトホルミンの併用により、T2DM患者においてHbA1c値の低下、体重減少、収縮期血圧の3~5mmHgの緩やかな減少が認められたと報告されている
The mechanisms underpinning the association between SGLT2 inhibitors and risk of death are not entirely clear. Experimental and clinical evidence suggest several putative mechanisms that might explain the beneficial properties of SGLT2 inhibitors on the risk of death, including hemodynamic (eg, natriuresis and osmotic diuresis, blood pressure reduction), metabolic (eg, weight loss), reduced inflammation and oxidative stress, and improved vascular endothelial function.It is plausible that several of these putative mechanistic pathways are contributing to the observed association of SGLT2 inhibitors with risk of all-cause mortality.
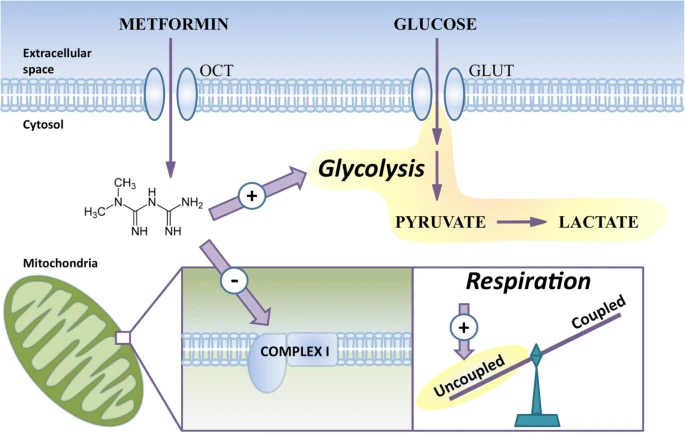
メトホルミンはミトコンドリアへの作用が主と考えられている。電子伝達系のエネルギーを"無駄遣い"を促す。
メトホルミンがミトコンドリアに直接作用し、クエン酸サイクル活性とOXPHOSを制限することを、単離ミトコンドリアと無傷の細胞で実証した。メトホルミンによるミトコンドリア機能の低下は、解糖の代償的な上昇を伴っていた。したがって、メトホルミンに対する細胞の感受性は、好気性解糖を行う能力に依存している。
メトホルミンはミトコンドリアに直接作用し、カップリング反応と非カップリング反応のバランスをシフトさせる。メトホルミンはトランスポーターのOCTファミリーを通じて細胞内に輸送され、そこでミトコンドリアに作用して複合体I依存性呼吸を阻害し、非結合性呼吸の割合を増加させる。細胞は解糖を増加させることで反応し、最終的に乳酸の産生を増加させる。
Metformin directly acts on mitochondria to alter cellular bioenergetics - PubMed (nih.gov)
この2種の薬剤とも乳酸産生性に傾く
SGLT2阻害剤にはグルコースを低下させる作用があるため、研究者らは低血糖のリスクを最小限にするために患者に投与するインスリンの量を減らした)。その結果、循環血中インスリン濃度が低下し、脂肪組織での脂肪分解と肝臓でのケトン体生成の速度が上昇し、循環血中ケトン体濃度が上昇すると予測される(図1)。ケトン体濃度の上昇に寄与する可能性のある薬物作用がさらに存在する。イヌの研究では、フロリジン(非選択的SGLT1/SGLT2阻害剤)がアセト酢酸の腎尿細管再吸収を促進することが証明された。この作用は、SGLT1/SGLT2を介したNa+再吸収の阻害により、尿細管液中のNa+濃度が上昇し、その結果、負に帯電したケトン体のキャリアを介した再吸収を促す電気化学的勾配が増加することに起因していると思われる。ケトン体産生量の増加と腎クリアランスの減少が相まって、循環ケトン体濃度が上昇するのであろう。したがって、インスリン依存性T1D患者にSGLT2阻害剤を投与すると、循環ケトン体濃度が上昇し、ケトアシドーシスを発症しやすくなるというのは、生物学的にもっともな話である。
SGLT2阻害剤の併用療法がケトーシスを促進し、T1D患者のケトアシドーシスのリスクを増加させる可能性のあるメカニズム。SGLT2阻害剤(SGLT2i)は、インスリン非依存性の機序でグルコースを減少させます。低血糖のリスクを最小限に抑えるために、T1D患者はインスリン投与量を減らす必要があるかもしれないが、これは脂肪組織の脂肪分解および肝性ケトジェネシスの速度を増加させると予測される。さらに、SGLT2阻害剤は、T2D患者の血漿中グルカゴン濃度を上昇させることが証明されており(12、13)、おそらくグルコースの尿中排泄量の増加を補うためであろう。さらに、最近、SGLT2阻害剤が膵臓のα細胞に直接作用してプレプログルカゴン遺伝子の発現を増加させることが報告されています(14)。さらに、フロリジン(SGLT1およびSGLT2の非選択的阻害剤)は、アセト酢酸の腎尿細管再吸収を増加させることが証明されている(9)。もし、選択的SGLT2阻害剤がフロリジンのこの作用を模倣するならば、ケトン体の腎クリアランスを減少させる可能性がある。
Perspectives in Endocrinology: SGLT2 Inhibitors May Predispose to Ketoacidosis (nih.gov)
一方、イメグリミン:Imeglimin(商品名:ツイミーグ)は乳酸血中濃度酸性増加は明確ではないそうだ。
Imegliminの2つの作用機序は、上記の糖尿病病態の分子的側面を標的とした、より特異的な作用に起因していると考えられる。すなわち、グルコース刺激インスリン分泌(GSIS)の増幅によるβ細胞機能不全の回復、肝臓および骨格筋におけるインスリン作用の増強である。これらの作用の背景には、複数の細胞種で示されたミトコンドリア機能の改善がある。さらに、Imegliminは、細胞内のNAD+プールを増加させ(膵島)、Ca++の動員やGSISの増強に関連することが分かっている。