ついでに水を15分に一回という神話を吹聴しているアホも・・・
https://www.mdlinx.com/internal-medicine/top-medical-news/article/2020/03/20/7625984/
故に、えらい学会から、お達し
HFSA/ACC/AHA statement addresses concerns re: using RAAS antagonists in COVID-19
https://professional.heart.org/professional/ScienceNews/UCM_505836_HFSAACCAHA-statement-addresses-concerns-re-using-RAAS-antagonists-in-COVID-19.jsp
Currently there are no experimental or clinical data demonstrating beneficial or adverse outcomes with background use of ACE inhibitors, ARBs or other RAAS antagonists in COVID-19 or among COVID-19 patients with a history of cardiovascular disease treated with such agents.:心血管疾患を有しACE阻害剤、ARBs、他RAAS拮抗剤の背景使用とに関わるなんの利益性・副事象アウトカムを示す実験的・臨床的データも無い
The HFSA, ACC, and AHA recommend continuation of RAAS antagonists for those patients who are currently prescribed such agents for indications for which these agents are known to be beneficial, such as heart failure, hypertension, or ischemic heart disease. : HFSA, ACC, AHAは心不全、高血圧、虚血性心疾患など既知のベネフィットを有する薬剤として適応のための現行処方されている患者ではRAAS薬剤の継続使用を推奨する
In the event patients with cardiovascular disease are diagnosed with COVID-19, individualized treatment decisions should be made according to each patient’s hemodynamic status and clinical presentation. Therefore, be advised not to add or remove any RAAS-related treatments, beyond actions based on standard clinical practice.:COVD-19診断された心血管疾患患者でさえ、血行動態や臨床的状態に応じて個別治療決定がなされるべきである。故に、標準的臨床に基づくアクションを超えて、RAAS-関連治療を付加・除去するべきなど助言すべきでない<hr>
COMMENTARY
Antihypertensive Drugs During COVID-19: Still Up in the Air
Sandra Adamson Fryhofer, MD
DISCLOSURES April 10, 2020
新規コロナウイルスは、肺、腸、腎臓、血管の上皮細胞で発現するACE 2を介して標的細胞に結合する。ACE阻害薬やARBの使用は、ACE 2の発現やアップレギュレーションを増加させる可能性がある。Roth氏らは書簡の中で、ウイルスの付着・攻撃の仕方から、ACE阻害薬やARBの使用は理論的には重症化・致死的疾患のリスクを高める可能性があると提案している。その1日後に発表されたJournal of Hypertension誌に掲載された別の論文でも、同じ赤旗を掲げている。米国心臓協会、米国心不全学会、米国心臓病学会の循環器専門医は共同声明の中で、COVID-19に感染したACE阻害薬やARBを服用している患者に対して、主治医から別段の助言がない限り、治療を継続するよう促した。欧州心臓病学会もこれに同意している。これらの薬剤を急に中止すると、心不全や制御不能な高血圧症を引き起こす可能性がある。JAMAのライブストリームで、JAMAの編集者であるHoward Bauchner氏とのディスカッションの中で、Anthony Fauci医師は、これはさらなる調査が必要であるとアドバイスした。同博士はBloomberg Newsがまとめたイタリアのデータを参照し、死亡した人の99%が前歴のある病状を持っていたことを明らかにした。その基礎疾患が何であったかを調べたところ、75%以上の人が高血圧であった。Fauci博士は、なぜ高血圧がコントロールされている人がCOVID-19で死ぬ可能性が高いのか疑問に思った。彼は、このことをより深く掘り下げ、それらの人々が服用していた薬を見つけることを促した。2020年3月30日にオンラインで掲載されたNew England Journal of Medicineの特別レポート「Reninin-Angiotensin-Aldosterone System (RAAS) Inhibitors in Patients with Covid-19」では、Brigham and Women's Hospital、Harvard Medical School、および他の高評価を受けているいくつかの機関の循環器専門医が、そうでなければ安定している患者にはこれらの薬剤を継続することを勧めている。前臨床試験では、レニン-アンジオテンシン-アルドステロン阻害薬がACE2発現を増加させる可能性があることが示されているが、ヒトでのデータは不足している。現在、ARBであるロサルタンと遺伝子組換えヒトACE2をCOVID-19患者を対象とした臨床試験が進行中である。もっと多くのデータが出てくるはずだ。今のところ、私は患者のために薬を変えていません。しかし、私たちは皆、このスレッドに注意深く従うべきである。サンドラ アダムソン フライホーファー、MD、MACP、FRCP、アトランタとエモリー大学医学部での医学の非常勤准教授の内科のボード認定医師です。彼女は、予防接種の実践に関する諮問委員会 (ACIP) への連絡係であり、いくつかのワクチンのための ACIP 作業部会に参加しています。
www.DeepL.com/Translator(無料版)で翻訳しました。
COVID-19 and Renin Angiotensin Blockers: Current Evidence and Recommendations
Franz H. Messerli , George C.M. Siontis, and Emrush Rexhaj
Originally published 13 Apr 2020
https://doi.org/10.1161/CIRCULATIONAHA.120.047022Circulation. ;0:null
https://www.ahajournals.org/doi/abs/10.1161/CIRCULATIONAHA.120.047022
SARS-CoV-2感染者では、一般的にCVD、特に高血圧と糖尿病が流行しています。RASブロッカーはCVDおよび高血圧治療に広く使用されている。
しかし、RAS遮断薬の作用を示唆する証拠には一貫性がない。
しかし、SARS-CoV-2感染者に特化したデータは得られていない。
逆に、CVDと高血圧の患者はSARS-CoV-2-感染を起こしやすいようであるが、これは交絡因子によるものである可能性が高い。
感染している患者では、臨床的に指示された通りにRAS遮断薬の投与を継続すべきである。
現在のところ、RAS遮断薬をリスクのある対象者に予防的に、あるいは感染した患者に治療的に使用することを推奨するには、十分な証拠がない。
ってことだが・・・
なにやらあやしい報告表題が・・
Chronic Use of Angiotensin-Converting Enzyme Inhibitors and Angiotensin II Receptor Blockers Is High Among Intensive Care Unit Patients With Non–COVID-19 Sepsis but Carry a Moderately Increased Risk of Death
Jonas Sunden-Cullberg
Originally published10 Apr 2020
https://doi.org/10.1161/HYPERTENSIONAHA.120.15178Hypertension. ;0:HYPERTENSIONAHA.120.15178
https://www.ahajournals.org/doi/abs/10.1161/HYPERTENSIONAHA.120.15178?af=R
有料アクセスするかどうか思案中
Renin–Angiotensin–Aldosterone System Inhibitors in Patients with Covid-19
List of authors.
Muthiah Vaduganathan, et al.
DOI: 10.1056/NEJMsr2005760

RAASの組織特異的および循環中の成分は、調節ペプチドと調節ペプチドの複雑な交差ネットワークを構成している(図1)。
ACE2はアンジオテンシンIIをアンジオテンシン-(1-7)に分解する重要な調節酵素であり、それによって血管収縮、ナトリウム保持、線維化への影響を減衰させる。アンジオテンシンIIはACE2の主な基質であるが、この酵素はアンジオテンシンIをアンジオテンシン-(1-9)に切断し、他のペプチドの加水分解にも関与している。ヒトでの研究では、15の臓器から採取した組織サンプルでは、心臓や腎臓だけでなく、SARS-CoV-2の主要標的細胞(および優性傷害の部位)である肺胞上皮細胞を含む広範囲にACE2が発現していることが示されている。興味深いことに、可溶性ACE2の循環レベルは低く、肺におけるACE2の機能的役割は、正常な状態では比較的最小限であるように見えるが、特定の臨床状態ではアップレギュレーションされている可能性がある。
コビド-19とレニン-アンジオテンシン-アルドステロン系の相互作用に関する重要なポイント
- ACE2は、RAASの活性化に生理的に対抗する酵素であり、Covid-19 pandemicの原因ウイルスであるSARS-CoV-2の機能的受容体である。
- 前臨床試験では、RAAS阻害剤がACE2発現を増加させる可能性が示唆されており、Covid-19患者における安全性に懸念が示されている。
- これらの観察結果が容易にヒトに適用されるかどうかを決定するためのデータは不十分であり、Covid-19試験におけるRAAS阻害剤の効果を評価した研究はない。
- ヒトACE2遺伝子組換え製剤やARBであるロサルタンを含むRAASモジュレーターの安全性と有効性を検証する臨床試験が進行中
- 心不全患者や心筋梗塞経験者を含むハイリスク患者において、RAAS阻害薬を急激に中止すると、臨床的に不安定になり、健康に悪影響を及ぼす可能性がある。
- さらなるデータが得られるまでは、RAAS阻害剤は、それ以外の安定した状態の患者で、Covid-19 のリスクがある、評価状態である、あるいは Covid-19を有しているを患者では、継続すべきであると考えている。
実験動物モデルでは、組織内の ACE2 レベルまたは活性に対する ACE 阻害薬の効果に関して、さまざまな知見が示されている。同様に、動物モデルでは、ARBのACE2への影響に関して一貫性のない知見が得られており、ARBが組織内のACE2のメッセンジャーRNA発現またはタンパク質レベルを増加させる可能性があることを示したものもあれば21,26-34、影響がないことを示したものもある。利用可能な動物モデルとは対照的に、ヒトではRAAS阻害がACE2発現に及ぼす影響に関する研究はほとんどない。ある研究では、冠動脈疾患患者にACE阻害薬を静脈内投与してもアンジオテンシン-(1-7)産生に影響を与えなかったが、これはACE阻害薬がACE2誘導型アンジオテンシンII代謝に直接影響を与えるかどうかに疑問を投げかけている。同様に、別の研究では、高血圧患者において、ACE阻害薬カプトプリルによる初期治療後、アンジオテンシン(1-7)レベルは影響を受けていないように思われたが、カプトプリルの単剤治療を6ヵ月間受けると、アンジオテンシン(1-7)レベルが上昇した36。ACE阻害薬による以前の治療は、ある研究ではACE2の腸内メッセンジャーRNAレベルの上昇と関連していたが、この関連はARBsでは観察されなかった25;ACE2の肺特異的発現に対するRAAS阻害薬の効果についてはデータが不足している。これらの一見相反するデータは、経路調節因子に対するRAASの応答の根底にある複雑さを示しており、前臨床モデルから得られた知見はヒトの生理学には容易には翻訳されないかもしれないという概念を補強している。このようなデータは、ACE2に対する効果がRAAS阻害薬間で一様であると仮定すべきではないことを示唆しており、また、特定の薬物クラス内の治療に対する反応であっても、ACE2に対する効果が一様であると仮定すべきではないことを示唆している41。血漿中の ACE2 レベルは、完全長膜結合型の活性を示す信頼できる指標ではないことに注意することが重要である。発現の程度に加えて、ACE2の生物学的関連性は組織や臨床状態によって異なる。残念ながら、実験動物モデルおよびヒトにおけるACE2の肺特異的発現に対するACE阻害剤、ARBおよびその他のRAAS阻害剤の影響を示すデータは不足している。さらに、RAAS阻害剤が標的組織床におけるACE2のレベルまたは活性(またはその両方)を修飾したとしても、それがSARS-CoV-2スパイク蛋白質の関与と侵入を促進するかどうかを示す臨床データは不足している。SARS-CoV-2とRAASネットワークとの間の特異的な相互作用をより明確にするためには、ヒトを対象とした更なるメカニズムの研究が必要である。
Angiotensin Converting Enzyme 2: A Double-Edged Sword
Kaiming Wang, Mahmoud Gheblawi, and Gavin Y. Oudit
Originally published 26 Mar 2020
https://doi.org/10.1161/CIRCULATIONAHA.120.047049Circulation. ;0:null
ACE2はユビキタスに発現しており、心血管系(CV)、腸、腎臓、肺で検出される最高レベルのレベルで発現している。
心血管系では、ACE2は心筋細胞、心外膜脂肪組織、心筋線維芽細胞、血管平滑筋、内皮細胞で発現しています1, 2ACE2は、それぞれアンジオテンシンII(Ang II)とアンジオテンシンI(Ang I)を生成するアンジオテンシン1-7(Ang 1-7)とアンジオテンシン1-9を含む様々なペプチドを加水分解する循環にさらされた触媒活性のあるエクトドメインを持つモノカルボキシペプチダーゼとして機能するtypeI膜貫通タンパク質です。
ACE2の可溶性フォームは、ADAM17で介するproteolytic cleavageを通過して膜から放出され、結果ACE2の組織RASに対するACE2 保護を失い、ACE2活性増加をもたらし、これはCV疾患の副次的マーカーとして知られている。
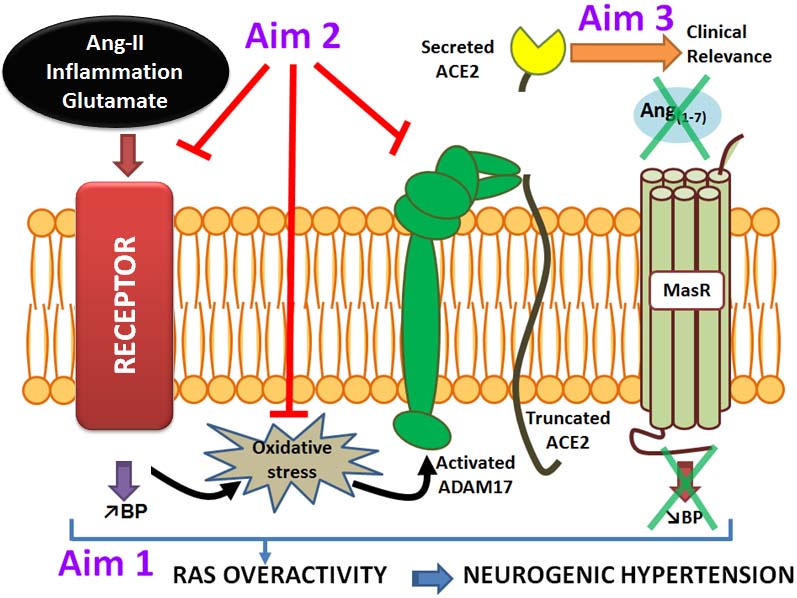
ACE2の発見は、RASの過剰活性化により病状に優勢な病因性のACE/Ang II/AT1受容体軸とのバランスをとるために、別の保護アーム、ACE2/Ang 1-7/Mas受容体軸を導入した)。
ACE による Ang I の切断は、ACE/Ang II/AT1 受容体軸の主要なエフェクターペプチドである Ang II を生成し、強力な血管収縮、炎症、細胞増殖、肥大、線維化、組織リモデリングを誘発します。ACE2 は Ang II を切断して心保護作用のある Ang 1-7 に変換し、Ang II シグナルの有害な作用に作用します。
したがって、ACE2は以下の2つの過程を経てRAS誘発性傷害から保護します。
(1) Ang IおよびAng IIを分解して、有害なACE/Ang II/AT1受容体軸における基質の利用可能性を制限すること、および
(2) 保護的なACE2/Ang 1-7/Mas受容体軸における基質の可用性を増加させるためにAng 1-7を生成する。
ACE2ノックアウトマウスとACE2阻害薬を用いた機能喪失実験では、心筋梗塞、高血圧、Ang II誘発性心筋肥大、微小血管合併症、炎症、線維化、拡張・収縮機能障害、酸化ストレスに対する感受性の増加が明らかにされている。
重要なことは、心不全や拡張型心筋症の患者から摘出したヒトの心臓に見られるように、ACE2の部分的な欠損は、心臓病への感受性を高めるのに十分であるということである。
逆に、組換えACE2、ACE2の過剰発現、および補助的なAng1-7を用いた機能獲得実験では、高血圧、糖尿病、および駆出率が保存された心不全(HFpEF)を含む様々なCV疾患モデルにおいて、保護的な役割を示している。
ACE阻害薬やARBなどのRASの薬理学的アンタゴニストは、病状に応じてACE2レベルを上昇させることでCVシステムを部分的に保護している。
肺動脈性肺高血圧症や急性肺損傷患者を対象とした遺伝子組換えヒトACE2(rhACE2)の静脈内投与による臨床試験では、血漿中のAng II/Ang 1-7比が速やかに低下することが報告されており、ACE2の機能とその治療効果を反映していると考えられる。
SARS-CoVおよびSARS-CoV-2のヒト細胞への結合および侵入は、ウイルススパイク糖タンパク質上のS1サブユニットの受容体結合ドメイン(RBD)とACE2のエクトドメインとの相互作用によって促進される。
ACE2のエンドサイトーシスは、ウイルス粒子と一緒にエンドソームに入ると、表面ACE2の発現を低下させ、ACE2が介在する組織保護への最初の障害となる。
特に懸念されるのは、最初のエンドサイトーシスイベントに続いてACE2発現のさらなるダウンレギュレーションを促進するために配置されている正のフィードバック経路であり、組織の損傷とSARS-CoV-2感染症からの組織RASのアンバランスを永続させる(図B)。
ウイルスの侵入はまた、ACE2細胞質ドメインに依存するプロセスであるSARS-CoVによってアップレギュレートされるADAM17活性によって促進される。
ADAM17プロテアーゼ活性のアップレギュレーションは、細胞表面からのACE2の損失を永続化させ、その結果、保護的なACE2/Ang 1-7/MAS受容体軸から疾患状態へのシフトとAng IIへの蓄積をもたらします。Ang IIはさらにADAM17活性をアップレギュレーターであるACE2をAT1受容体および下流のERK/p38 MAPキナーゼシグナル伝達経路を介して、SARS-CoV-2受容体結合の後遺症として排出するという特徴的な正のフィードバックループでアップレギュレーションする。
さらに、ADAM17はまた、TNFα、IFN-γ、およびIL-4の膜結合前駆体の循環中への解放を仲介し、その代替的な名前である腫瘍壊死因子変換酵素(TACE)を生じさせた。
これらのサイトカイン、すなわちIL-4およびIFN-γは、ACE2の細胞表面発現をダウンレギュレートし、ACE2のmRNAレベルを低下させ、SARS-CoV-2誘発の全身および組織の炎症からACE2を喪失させる別の経路を導く。
肺損傷では、ACE2のダウンレギュレーションを介したRASの制御の低下は、AT1受容体遮断により減衰するAng IIの作用を介して、SARS-CoV感染症における血管透過性、肺水腫および損傷の重症度を増加させる。
SARS に感染した患者の死後剖検例の心臓組織では、心筋線維が増加していることが明らかになった。
Coronavirus Disease 2019 (COVID-19) and Cardiovascular Disease
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.046941心筋障害は心バイオマーカーなど(hs-cTnや心電図、エコー所見など)により早期から認識されていた。hs-cTN 99パーセンタイル以上は、非生存 46% vs 生存 1%と極端な差がある。さらに、他のバイオマーカー(D-dimer、フェリチン、IL-6、LDH)の増加から、サイトカインストーム(でた!;訳者の独り言)や二次性heophagocytic lymphohistiocytosisが示唆される。
One potential mechanism is direct myocardial involvement mediated via ACE2. A murine model demonstrated pulmonary infection with SARS-CoV also precipitated an ACE2‐dependent myocardial infection.
Among humans, during the Toronto SARS outbreak,SARS-CoV viral RNA was detected in 35% of autopsied hearts. Other suggested mechanisms of COVID-19 related cardiac involvement include a cytokine storm, mediated by an imbalanced response among subtypes ofT helper cells, and hypoxia induced excessive intracellular calcium leading to cardiac myocyte apoptosis.
Role of angiotensin converting enzyme inhibitors (ACEi) and angiotensin receptor blockers (ARB)ACE2 is a homolog of ACE that converts angiotensin II to angiotensin 1-7 ,thereby diminishing vasoconstriction mediated by the renin angiotensin system.
The use of ACEi and ARB are common in cardiovascular disorders (HTN, coronary artery disease, congestive heart failure, and DM).
There are conflicting data from studies demonstrating whether these drugs increase or have minimal effect on ACE2 levels.
SARS-CoV-2 entry into cells is ACE2 dependent(Figure 4);however,ACE2 appears to be protective against acute lung injury.
In a murine model, binding of the SARS-CoV spike protein to ACE2 caused ACE2 downregulation, leading to an increase in angiotensin II and ultimately increased pulmonary vascular permeability, inducing pulmonary edema, and reduced lung function.
However, treatment with recombinant ACE2 and losartan mitigated the degree of lung injury.On this basis losartan is being studied for potential mitigation of lung injury among both inpatients and outpatients withCOVID-19.
At this time nearly all major societies have recommended against adding or stopping ACEi, ARB,or other RAAS antagonists in this setting, unless done on clinical grounds independently of COVID-19, given the lack of evidence currently available on their potential benefit or harm.
;Google翻訳
潜在的なメカニズムの1つは、ACE2を介した直接的な心筋病変です。マウスモデルは、SARS-CoVによる肺感染もACE2依存性心筋感染を引き起こしたことを示しました。ヒトでは、トロントSARSの発生時に、SARS-CoVウイルスRNAが剖検心臓の35%で検出されました。COV-19に関連する他の心臓関与の示唆されるメカニズムには、Tヘルパー細胞のサブタイプ間の不均衡な応答によって媒介されるサイトカインストーム、および心筋細胞アポトーシスにつながる過剰な細胞内カルシウムが含まれます。
アンギオテンシン変換酵素阻害剤(ACEi)およびアンギオテンシン受容体遮断薬(ARB)の役割としてのACEiおよびARBの使用は、一般的な心血管障害(HTN、冠動脈疾患、うっ血性心不全、およびDM)です。これらの薬物がACE2レベルに増加するか、最小限の影響しか与えないことを実証する研究から矛盾するデータがあります。細胞へのSARS-CoV-2の侵入はACE2依存的である(図4);しかし、ACE2は急性肺損傷に対して保護的であると思われる。マウスモデルでは、SARS-CoVスパイクタンパク質のACE2causedACE2ダウンレギュレーションへの結合により、アンジオテンシンIIが増加し、最終的に肺血管透過性が増加し、肺水腫が誘発され、肺機能が低下します。ただし、組換えACE2とロサルタンによる治療は肺損傷の程度を軽減しました。これに基づいて、ロサルタンは、COVID-19の入院患者と外来患者の両方における肺損傷の潜在的な緩和について研究されています。現時点で、ほとんどすべての主要な社会は、潜在的な利益または害に関して現在利用可能な証拠が不足しているため、この設定でACEi、ARB、または他のRAAS拮抗薬を追加または停止することを推奨しています。
Renin-Angiotensin System Blockers and the COVID-19 Pandemic
At Present There Is No Evidence to Abandon Renin-Angiotensin System Blockers
A.H. Jan Danser , et al.
published25 Mar 2020
https://doi.org/10.1161/HYPERTENSIONAHA.120.15082Hypertension.
https://www.ahajournals.org/doi/abs/10.1161/HYPERTENSIONAHA.120.15082
重症急性呼吸器症候群コロナウイルス-2の伝播の間に、まだ出現しているデータのいくつかの報告は、完全な分析を必要としており、特定のグループの患者がCOVID-19のリスクにあることを示している。これには、高血圧、心臓病、糖尿病、および明らかに高齢者の患者が含まれる。これらの患者の多くは、レニナンジオテンシン系ブロッカーで治療されている。ACE2(アンジオテンシン変換酵素2)タンパク質は、コロナウイルスの細胞内への侵入を促進する受容体であるため、レニン・アンジオテンシン系遮断薬による治療は、重症で致死的な重症急性呼吸器症候群コロナウイルス2感染症を発症するリスクを高める可能性があるという考え方が普及してきた。本論文では、この概念について論じている。ACE2の全長型は膜結合型の酵素であるが、短鎖型(可溶性)は血中に非常に低いレベルで循環している。モノカルボキシペプチダーゼとして、ACE2はアンジオテンシンIとIIを含むいくつかの基質の分解に寄与する。ACE(アンジオテンシン変換酵素)阻害剤は、ACEとACE2は異なる酵素であるため、ACE2を阻害しない。アンジオテンシンII型1受容体遮断薬は、実験動物においてACE2をアップレギュレートすることが示されているが、その証拠は常に一貫しておらず、多様なアンジオテンシンII型1受容体遮断薬や異なる器官の間で異なっている。さらに、ACE阻害薬またはアンジオテンシンII型1受容体拮抗薬の投与が、動物またはヒトのいずれにおいてもACE2発現を増加させることによってコロナウイルスの侵入を促進するという考えを支持するデータはない。実際、動物のデータは、ACE2発現の上昇が潜在的な肺および心血管系の保護効果をもたらすことを支持している。要約すると、現在利用可能なエビデンスに基づいて、レニン-アンジオテンシン系遮断薬による治療は、コロナウイルス感染の懸念から中止すべきではない。
Translated with www.DeepL.com/Translator (free version)
最近のSARS-CoV-2の報告で高血圧がどのように分類されたかは明らかになっていない1)が、実際の血圧測定ではなく、高血圧治療薬の使用に基づいているのではないかと推測するしかない。高血圧患者が重篤で致死的なSARS-CoV-2感染症にかかりやすいかどうかを真に検討するためには、高血圧患者と高血圧でない患者のコホートにおけるSARS-CoV-2感染症の発生率を、同様の曝露歴を持つ前向きコホート研究が必要である。その代わりに報告されているのは、SARS-CoV-2患者の高血圧歴とそうでない患者の高血圧歴であり、何の調整も行われていない(例えば年齢)。因果関係としてのRAS遮断薬の使用は、ここで議論されているように、エビデンスに欠ける仮定である。したがって、高血症、心不全、またはその他の内科的適応でACE阻害薬やARBを服用している患者は、医師や医療提供者から特に勧められない限り、現在の治療レジメンを中止すべきではないことを強く推奨する。さらに注意すべき点がある。薬の変更によって起こりうる高血圧症の血圧コントロールの不安定化は、脳卒中や心筋梗塞を引き起こす可能性がありますが、これは明らかに仮定の話ではありません。降圧剤を単に中止することは強く推奨されず、世界中でRASブロッカーが広く使用されていることを考慮すると、選択肢に入れてはならない。特にアジア人は咳が出やすいようで、ARBの使用が望ましいかもしれません。
欧州からの・・・誤解招きそうな記載
Vulnerable groups: Data from Italy corroborate previously identified population groups at higher risk for having severe disease and death. These groups are elderly people above 70 years of age, and people with underlying conditions such as hypertension, diabetes, cardiovascular disease, chronic respiratory disease and cancer [8,18,20,56,57]. Men in these groups appear to be at a higher risk than females. Chronic obstructive pulmonary disease (COPD), cardiovascular diseases, and hypertension have been identified as strong predictors for ICU admission [20].https://www.ecdc.europa.eu/sites/default/files/documents/RRA-seventh-update-Outbreak-of-coronavirus-disease-COVID-19.pdf
Higher ACE2 (angiotensin converting enzyme II) gene expression may be linked to higher susceptibility to SARSCoV-2. It has been shown that ACE2 expression in lung tissues increases with age, tobacco use and with some types of antihypertensive treatment. These observations might explain the vulnerability of older people, tobacco users/smokers and those with hypertension; they also highlight the importance of identifying smokers as a potential vulnerable group for COVID-19 [54,58-60].
こういう書き方すれば・・・そりゃ誤解も・・・
欧州も一応
Based on initial reports from China, and subsequent evidence that arterial hypertension may be associated with increased risk of mortality in hospitalized COVID-19 infected subjects, hypotheses have been put forward to suggest a potential adverse effects of angiotensin converting enzyme inhibitors (ACE-i) or Angiotensin Receptor Blockers (ARBs). It has been suggested, especially on social media sites, that these commonly used drugs may increase both the risk of infection and the severity of SARS-CoV2. The concern arises from the observation that, similar to the coronavirus causing SARS, the COVID-19 virus binds to a specific enzyme called ACE2 to infect cells, and ACE2 levels are increased following treatment with ACE-i and ARBs.https://theskepticalcardiologist.com/2020/03/14/coronavirus-and-ace-inhibitors-do-not-stop-taking-your-blood-pressure-medication/
Because of the social media-related amplification(ネットによるゴミ情報増幅機能により), patients taking these drugs for their high blood pressure and their doctors have become increasingly concerned, and, in some cases, have stopped taking their ACE-I or ARB medications.
This speculation about the safety of ACE-i or ARB treatment in relation to COVID-19 does not have a sound scientific basis or evidence to support it. Indeed, there is evidence from studies in animals suggesting that these medications might be rather protective against serious lung complications in patients with COVID-19 infection, but to date there is no data in humans.
The Council on Hypertension of the European Society of Cardiology wish to highlight the lack of any evidence supporting harmful effect of ACE-I and ARB in the context of the pandemic COVID-19 outbreak.
<hr>
エナラプリルやラミプリルなどのアンジオテンシン変換酵素阻害薬(ACE-1阻害薬)やカンデサルタンやバルサルタンなどのアンジオテンシン受容体拮抗薬(通称:アンジオテンシン受容体拮抗薬またはARB)は、COVID-19と呼ばれる感染症の原因であるコロナウイルスSARS-CoV-2(別名:2019-nCoV)の予防および治療に価値があるのではないかと示唆されてきた。しかし、有効性を示す試験的なエビデンスはまだなく、このような介入の使用による弊害の可能性や、潜在的な利益と弊害のバランスが個人間でどのように異なるのかについては、ほとんど注目されていませんでした。現在(2020年3月21日現在)、WHOのウェブサイトであるICTRP(International Clinical Trials Registry Platform)には、中国で提案されている、または進行中の3つの関連試験が掲載されています。1つ目は、「2019-nCoV感染症で苦しんだときのACEI治療の有無による高血圧患者の臨床的特徴の違い」と題して2月12日に登録され、募集中とされている。他の2つは募集していない。"Recombinant human angiotensin-converting enzyme 2 (rhACE2) as a treatment for patients with COVID-19」(2月21日に登録されたが、clinicaltrials.govには撤回されたと記載されている)と「Clinical study for the effects of ACEIs/ARBs on the infection of novel coronavirus pneumonia (CoVID-19)」(3月2日に登録された)である。
<img src="https://www.cebm.net/wp-content/uploads/2020/03/ACE-2.png">
Coronaviruses are single-stranded RNA viruses, about 120 nanometers in diameter. Their resemblance to the sun with a corona, as seen during an eclipse, is due to so-called spike glycoproteins, or peplomers, on the surface, which enable coronaviruses to enter host cells. SARS-CoV-1 and SARS-CoV-2, which share about 80% structural identity, do this by harnessing the action of the angiotensin converting enzyme, ACE-2, which is expressed in the membranes of many cells in the body, including lung alveolar epithelial cells.
The spike glycoproteins have two subunits; one subunit, S1, binds to the receptors on the cell surface; the other subunit, S2, fuses with the cell membrane.
A host transmembrane serine protease, TMPRSS2, promotes entry of SARS-Cov into cells by two separate mechanisms.:2つの独立したメカニズムで、細胞内へ侵入する
After the S1 subunit of the spike binds to the ACE-2 enzyme on the cell membrane surface, TMPRSS2 activates the spike and cleaves ACE-2. :スパイクのS1サブユニットが細胞表面のACE-2酵素と結合した後、TMPRSS2がスパイクを活性化させ、ACE-2をぶった切る。
TMPRSS2 also acts on the S2 subunit of the spike glycoprotein, causing an irreversible conformational change, activating it, and facilitating fusion of the virus to the cell membrane. :TMPRSS2はまたスパイク糖鎖蛋白のS2サブユニットで作用し、不可逆的なcomformation変化をもたらし、活性化し、細胞表面へのウィルスのfusion促進する
フサン(serine protease inhibitor, camostat mesylat)は、TMPRSS2を阻害し、ウィルスの侵入を阻害する可能性がある
細胞膜におけるACE-2の活性を低下させることで、理論的にはSARS-CoV-2の細胞への侵入能力を低下させることが可能である。しかし、現在高血圧や心不全の治療に用いられているエナラプリルやラミプリルなどのACE-1阻害薬は、ACE-2を阻害しない。ACE-1を阻害すると、循環アンジオテンシンIの濃度が上昇し、アンジオテンシンに変換される可能性がある。しかし、アンジオテンシン(1-9)からアンジオテンシン(1-7)への代謝は、ACE-1によって触媒され、ACE-1阻害剤の存在下では、どの程度までも進行しないであろう。ACE-1の阻害によるアンジオテンシンIの増加量の存在は、ACE-2をアップレギュレーションする傾向があるかもしれない。実際、実験動物では、ACE-1阻害剤とARBの両方が心臓ACE-2の活性を増加させる。このようなアップレギュレーションが望ましいかどうかは明らかではない。
アンジオテンシン(1-9)からの産生が減少しているにもかかわらず、ACE-2の作用下でアンジオテンシンIIからのアンジオテンシン(1-7)の産生が増加することは、COX-2合成の阻害によって部分的に媒介される抗炎症活性の増加、およびウイルスによって引き起こされる肺の損傷からのある程度の保護につながる可能性がある。しかし、アンジオテンシンII濃度はACE-1阻害薬によって低下するため、大きな効果は期待できない。いずれにしても、例えば、NSAIDやコルチコステロイドの投与による抗炎症活性の増加は、有益ではなく、ウイルス感染症では有害である可能性があり。
実験動物において、ACE-2がイブプロフェンによってアップレギュレートされていることを一瞥しておく。
www.DeepL.com/Translator(無料版)で翻訳しました。


0 件のコメント:
コメントを投稿