以前から免疫反応異常を伴う凝固障害がこのCovid-19の重要な特徴とされている。
SARS-CoV-2 virus causes severe multisystem disease beyond acute respiratory distress syndrome. The mechanism of nonpulmonary involvement seems to involve a coagulopathy driven by a dysregulated immune response.
https://www.jwatch.org/na52191/2020/08/17/immunothrombosis-pathogenesis-covid-19-coagulopathy
そのstate of the artレビュー
「免疫血栓」(Immunothrombosis)と静脈血栓塞栓
State of the art review
COVID-19, immunothrombosis and venous thromboembolism: biological mechanisms
Joan Loo, et al.
Thorax https://thorax.bmj.com/content/early/2021/01/06/thoraxjnl-2020-216243
COVID-19で頻繁に起こる血栓性イベントは、主に静脈血栓塞栓症(VTE)であり、疾患の重症度の増加および臨床転帰の悪化と関連している。COVID-19の特徴的な微小血管異常には、内皮の炎症、細胞間結合の破壊、微小血栓形成が含まれる。COVID-19では、サイトカインの増加、血小板、内皮および補体の活性化とともに、COVID-19に関連した明らかな凝固障害が発生し、これは疾患の重症度が悪化するにつれてより頻繁に発生する。このような炎症性の環境は、免疫血栓症を引き起こす可能性があり、これは宿主の防御機構が制御不能になり、免疫学的に媒介された血栓が過剰に形成され、主に微小血管系に影響を及ぼすことになります。止血系と免疫系は複雑に関連しており、COVID-19のVTEと免疫血栓症には多因子プロセスが関与している可能性が高い。この最新のレビューでは、COVID-19の免疫血栓症とVTEの病態生物学的メカニズムに焦点を当てて探っていく。COVID-19に関連する凝固障害、病理学、内皮機能障害と止血、免疫系と血栓症、遺伝的関連、追加の血栓症メカニズムに焦点を当てています。これらのプロセス間の複雑な相互作用を理解することは、新しい治療法がCOVID-19のVTEおよび免疫血栓症にどのように影響するかを開発し評価するために必要である。
COVID-19の凝固カスケード異常
凝固カスケードは、内皮下からのプロトロンボ性タンパク質への曝露、または組織因子の発現に続くことで開始され、それぞれ内因性経路および外因性経路と呼ばれている。内在性経路および外在性経路の臨床的調査は、活性化部分トロンボプラスチン時間(aPTT)およびプロトロンビン時間(PT)によってそれぞれ測定することができる。一連の連続的な開裂が起こり、それによってタンパク質分解凝固因子が循環中の不活性因子を活性型に変換する。どちらの経路も共通の経路に到達し、活性化因子Xがプロトロンビンを切断してトロンビンを形成する。トロンビンはフィブリノーゲンを切断してフィブリン鎖を生成し、これが急速に重合して血小板凝集体を安定化させ、血栓を形成する。フィブリンはプラスミンによって分解され、組織プラスミノーゲンアクチベーター(tPA)はプラスミノーゲンの切断を促進してプラスミンを生成する。COVID-19、特に重篤な疾患に異常があるか、または仮説的に関連している凝固カスケードの構成要素は、斜線付きの記号で示されている。COVID-19では、組織因子経路阻害剤(TFPI)、第8因子、フィブリノーゲン、プラスミノーゲン活性化因子阻害剤-1(PAI-1)およびフィブリン分解産物(FDP)が上昇していることが示されている。PTの延長も報告されています。研究では、COVID-19における血小板数およびtPAのレベルの低下が示されている。上昇したパラメータは↑の記号で示され、低下したパラメータは↓の記号で示されています。
COVID-19における内皮機能障害
COVID-19における内皮機能障害は、複数のメカニズムおよび沈殿因子を介して起こりうる。SARS-CoV-2の内皮細胞への直接侵入は、細胞間接合を乱し、原血栓性内皮下コラーゲンを露出させる細胞損傷を引き起こす。ACE2受容体の内在化は、Ang1-7とAngIIのバランスを崩し、後者に有利になる。AngIIの蓄積は、P-セレクチン、組織因子(TF)、フォン・ウィレブランド因子(VWF)の内皮発現を促進する。内皮細胞内での細胞内ウイルス複製は、内皮細胞の活性化とプロトロンボリックタンパク質の発現をもたらす。これらのプロトロンボティック蛋白質の発現は、外因性凝固カスケードを活性化する。内皮損傷部位への血小板の同時リクルートは、さらに高凝固性を助長する。ポリリン酸塩は活性化された血小板から分泌され、凝固因子の活性化を促進する。ポリリン酸塩は組織因子経路阻害剤(TFPI)を阻害し、フィブリンの重合を促進する。局所的な低酸素は、内皮表面でのP-selectin、TFおよびVWFの発現を誘導することにより、プロトロンボティック表現型を悪化させる。シクロオキシゲナーゼ(COX)経路の低酸素誘導活性化はトロンボキサンA2およびB2(それぞれTxA2およびTxB2)を放出する。TxA2とTxB2は、平滑筋細胞に存在するトロンボキサンプロスタノイド受容体(TPR)に結合し、血管収縮を引き起こす。
ICAM-1, intercellular adhesion molecule-1; PAI-1, plasminogen-activator inhibitor-1; tPA, tissue plasminogen activator; VCAM-1, vascular cell adhesion molecule-1.
免疫系と血栓症
止血と免疫システムは複雑に関連しており、2つのシステムが相互に補完し合って宿主の防御を行い、侵入してくる病原体の拡散を制限している。生理的な免疫血栓症は、免疫学的に媒介された血栓が過剰に形成され、その結果、主に微小血管系に影響を及ぼすことになります。免疫血栓症はCOVID-19患者における重要な病理学的機序として提案されており、自然免疫細胞の活性化、過剰な凝固および内皮機能不全が、観察される血栓症の状態に寄与している。自然免疫の活性化は、凝固系によって誘導され得る;トロンビンおよび第Xa因子は、それらのプロテアーゼ活性化受容体を介して自然免疫細胞を活性化することができる。同様に、フィブリノーゲンおよびフィブリンは好中球の活性化を開始することが示されている
COVID-19における免疫血栓症
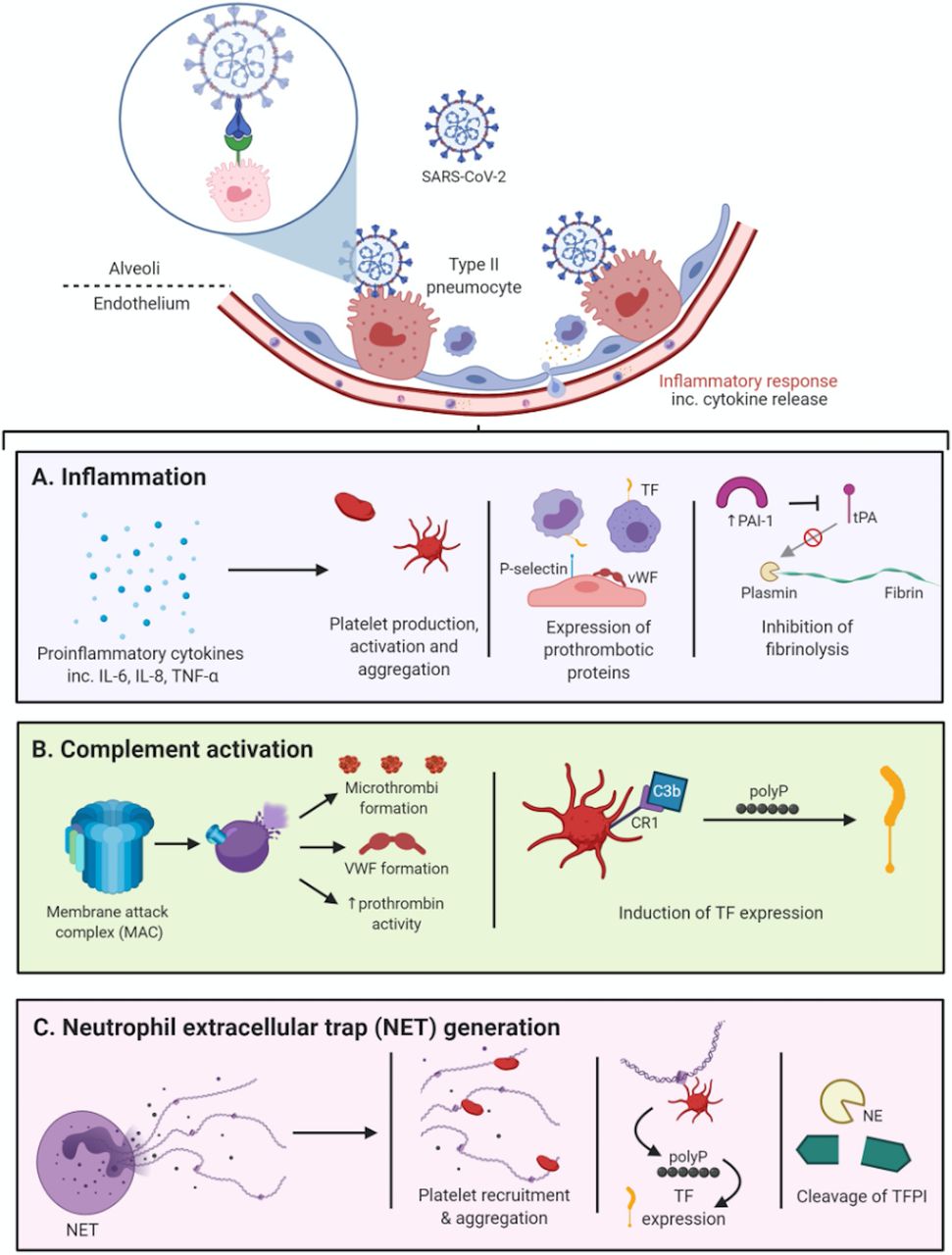
SARS-CoV-2の肺胞内のタイプII肺細胞への初期結合は、大量の自然免疫細胞の浸潤(単球、マクロファージおよび好中球を含む)をもたらす。その後、これらの免疫細胞からのサイトカインの放出は、様々な提案されているメカニズムを介して、高凝固状態に寄与する。(A)
炎症性サイトカインの放出は、血小板の放出およびその活性化および凝集を誘導し得る。 特にインターロイキン(IL)-6は、非炎症性環境下で産生される血小板よりも顕著に血栓形成能を有する血小板の産生を促進することが示されている。好中球によって産生されるセリンプロテアーゼであるカテプシンGもまた、血小板を活性化する。 腫瘍壊死因子(TNF)-αおよびIL-6は、多くの異なる細胞型、すなわち単球、マクロファージおよび内皮細胞による組織因子(TF)発現をアップレギュレートする。 さらに、TNF-αは、プラスミノーゲン活性化インヒビター-1(PAI-1)の上昇を誘発し、これにより、組織プラスミノーゲン活性化因子(tPA)が阻害されます。その結果、プラスミンの活性が低下し、線溶を減少させる。(B)
補体の活性化は凝固の重要な誘導因子である。 膜攻撃複合体(MAC)は、末端補体複合体C5b-9とも呼ばれ、補体タンパク質の逐次切断および活性化の複合カスケードの終点である。 MACは多数の補体タンパク質サブユニットから構成され、膜貫通チャネルとして機能し、それらが埋め込まれた標的細胞の細胞溶解を開始します。宿主細胞の細胞溶解と死は、プロトロンビン活性を増加させるだけでなく、ミクロトロンビとフォン・ウィレブランド因子(VWF)の形成を開始することにより、凝固症に寄与する。 補体の活性化が凝固に寄与するもう一つのメカニズムは、血小板の膜上に存在するCR1受容体へのC3bの結合を介したものである。C3bの結合は、血小板から短鎖ポリリン酸(polyP)の放出を誘発し、TFの発現を誘導する。 補体成分C5aもまた、好中球のリクルートに寄与する可能性がある。(C)
好中球による防御機構として、好中球細胞外トラップ(NET)の生成は、また、凝固を促進する。NETの主成分であるヒストンは、血小板を引きつけて結合し、その結果、血小板が凝集する。ヒストンへの結合の結果として血小板の活性化は、TFの発現を誘導する。好中球エラスターゼ(NE)は、組織因子経路阻害剤(TFPI)を切断し、それによってTFの禁止されていない作用を可能にします。
血栓性メカニズムの追加
COVID-19の血栓症には他にも様々な機序があると考えられている。COVID-19におけるフェリチンの増加レベルは、細胞の損傷を反映している可能性が高く、炎症に寄与している可能性がある。フェリチンの高レベルはミトコンドリアに有害な影響を与え、細胞死の原因となる活性酸素種の放出を引き起こす可能性がある。血小板におけるミトコンドリアの機能不全は、炎症や血栓症の一因となる可能性がある。
抗リン脂質抗体(APA)価の上昇はCOVID-19で報告されているが、その意義は不明である。抗リン脂質抗体(APA)は内皮、白血球、血小板と相互作用し、血栓性因子の放出を誘発し、補体系と相互作用することができます。
肥満は、COVID-19およびVTEの危険因子である長期および亜急性炎症性疾患である。脂肪細胞の肥大および関連する脂肪代謝の機能不全は、凝固系を活性化するIL-6、PAI-1およびTFの放出を引き起こす。血小板凝集もまた、アディポネクチンの放出が減少し、レプチンの放出が増加することで促進される。肥満に関連するインスリン抵抗性もまた、インスリンが血小板活性に及ぼすと思われる調節効果を低下させる。 肥満における炎症状態は、COVID-19との関連を説明し、VTEのリスクの増加につながる可能性がある。
www.DeepL.com/Translator(無料版)で翻訳しました。


0 件のコメント:
コメントを投稿