好酸球にて慢性炎症性気道疾患を評価する場合の限界(序文から)
現在、いくつかの課題が、臨床におけるバイオマーカーとしての血中EOS数の適用を制限するものと認識されている。無作為化比較試験のデータに基づく異なる予測カットオフポイントが喘息およびCOPDで報告されており [13-17] 、最近のデータは血中EOS数が二値ではなく連続変数であることを示唆している [18, 19]。異なる集団や状態における血中EOSの「正常」レベルと見なされるものについての現在の理解を支持する強固な証拠はほとんど存在しない。健康な集団における研究は、年齢、性別、アトピーおよび環境暴露などの様々な要因からの潜在的交絡を伴う、EOS数を含む広範な血液成分を示している[20-23]。これらの因子が正常な血中EOSの範囲に潜在的に影響を及ぼす可能性がある一方で、疾患状態における基礎的な炎症もまた影響を及ぼします。炎症は喘息では好酸球性、COPDでは好中球性であるため、血中EOS値は喘息で高く、COPDで低いと、必ずしも証拠に基づくものではないが、単純に認識される結果となる可能性がある。喘息やCOPDにおいて治療効果のバイオマーカーとして血中EOS数を用いるためには、血中EOS数の分布や範囲についてより深く理解することが臨床的な背景として必要。
Blood eosinophil counts in the general population and airways disease: a comprehensive review and meta-analysis
Victoria S. Benson, et al.
European Respiratory Journal 2022 59: 2004590;
DOI: 10.1183/13993003.04590-2020
訳文
日本語
背景 喘息およびCOPDの治療反応性バイオマーカーとして血中好酸球(EOS)数を使用する臨床的背景には、EOSの分布と範囲についての理解を深めることが必要である。我々は、喘息、COPD、コントロール(非喘息・COPD)および一般集団で発表されたEOSの分布と範囲について説明する。
方法 喘息、重症喘息、COPD、コントロール、一般集団におけるEOS数を含む観察研究(2008年1月~2018年11月)の包括的な文献レビューとメタ解析を行った。除外した研究は、総標本数200未満、EOSを含める基準、入院患者集団のみ、小児参加者のみであった。
結果 全体で91件の適格な研究が同定され、ほとんどが喘息(39件)、重症喘息(12件)、COPD(23件)、コントロール(7件)、一般集団(14件)の全人口レベルのデータを入手できたが、複数の集団に関するデータを報告している論文もあった。報告されたEOSの分布は右肩上がりであった(7件の研究)。報告されたEOS数の中央値は、157~280個-μL-1(喘息、22試験)、200~400個-μL-1(重症喘息、8試験)、150~183個-μL-1(COPD、6試験)、100~160個-μL-1(コントロール、3試験)、および100~200個-μL-1(一般集団、6試験)であった。メタアナリシスでは、観察されたばらつきのほとんどが、研究内というよりも研究間であることが示された。血中EOS数の上昇と関連すると報告された因子は、現在の喫煙、皮膚プリックテスト陽性、総IgEの上昇、併存するアレルギー性鼻炎、年齢≦18歳、男性性、呼吸器喘息・COPD診断、代謝症候群、脂肪率などであった。
結論 EOSの分布と範囲は研究集団によって異なり、年齢、喫煙歴、併存疾患を含む臨床的要因に影響され、重症度にかかわらず、治療方針の決定時に考慮されるべきものであった。
Çolakら[41]は、以下の因子が血中EOS数300個-μL-1以上と関連していると報告した:年齢(10年当たり高い);性別(男性対女性);BMI(10kg-m-2当たり高い);喫煙歴(10パック年当たり高い);アレルギー;気道薬の使用;パーセント予測FEV1<80%および/または正常下限(LLN)未満;FEV1/FVC比<0.70および/またはLLN未満 [41].これらの因子は図4aに示されている。逆に、COPDの家族性素因は、血中EOS数の低下と関連していた[41]。
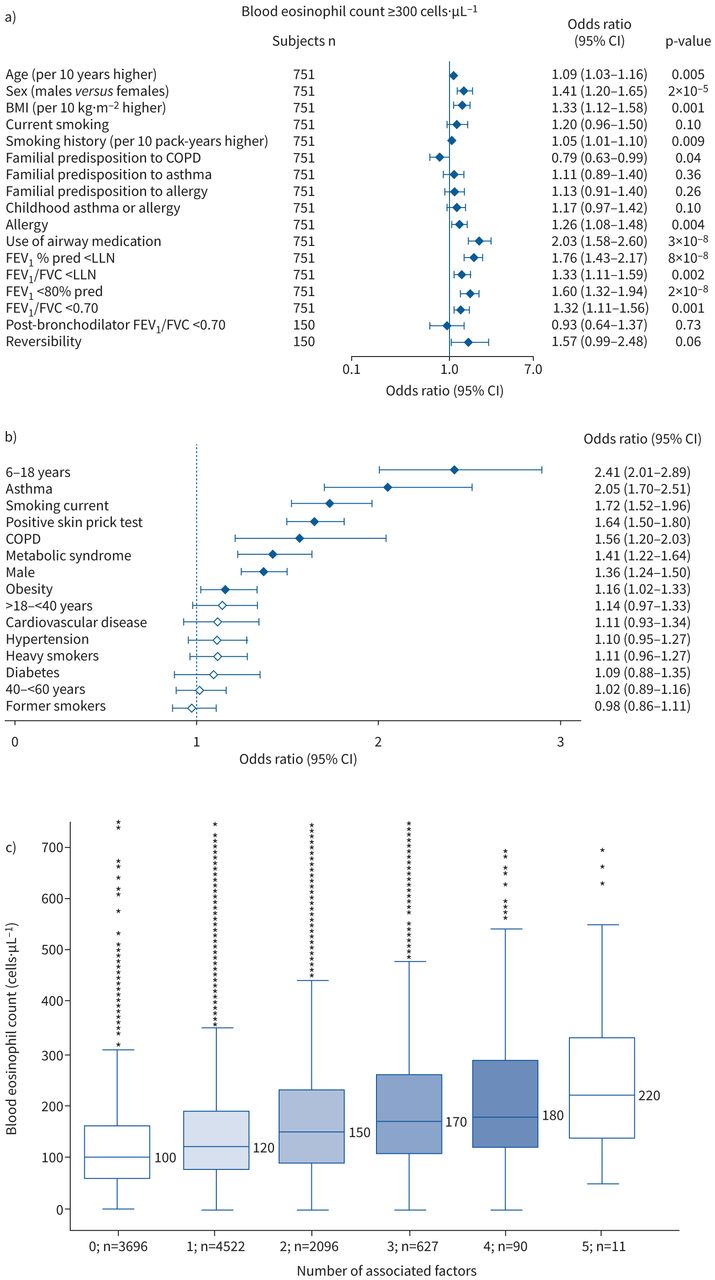 |
| 図 4a |
しかし、このレビューが考案され、完了してから、さらに2つの関連する研究が発表された[23, 26]が、これらの研究は、高い血中EOS数を定義するための≧300 cells-μL-1 のカットオフを使用していないことに注意すべきである。Lung, hEart, sociAl, boDy (LEAD) studyは、オーストリアの大規模な一般集団研究であり、11,042人の参加者を対象にしたもので、若年(18歳以下)、男性、喘息の呼吸器診断、現在の喫煙(ただし累積元喫煙20箱年以上)、皮膚プリックテスト (SPT) 陽性、および、喘息(spirometric) 診断は、喘息(respiratory)の発症を示唆するものであった。LEAD研究データ[23]の75パーセンタイルを用いて決定したカットオフ点による多変量解析では、COPD診断、メタボリックシンドロームの存在、脂肪率はすべてEOS≥210細胞-μL-1の高さと有意に関連していた(図4bおよびc)。糖尿病、高血圧および心血管疾患は、この大規模な一般集団のサンプルにおける高いEOS数とは関連しなかった[23]。さらに、付随する関連因子の数の増加は、より高いEOSカウントと関連していた[23]。ブラジルの喘息患者と非喘息対照者(n=454)で実施されたProgram for Control of Asthma in Bahia(ProAR)研究の解析では、SPT陽性、総IgEの上昇、併存するアレルギー性鼻炎および現在の喫煙者であることはすべて、血中EOS数が高いことと関連していた[26](図4dおよびe)。この研究では、「血中EOS数が多い」ことを定義するための特定の閾値を使用せず、代わりにどの患者サブグループが有意に異なる中央値を有するかを特定した;これらのサブグループの中央値の最高は252 cells-μL-1(現在の喫煙者)であった[26]。層別化された方法で分析すると、これら4つの同定された危険因子のいずれも持たないことは、106細胞-μL-1の血中EOS数の中央値と関連し、危険因子1つで153細胞-μL-1に増加し、さらに危険因子2~4で190~192細胞-μL-1に増加した[26]。全体として、これらのデータは、血中EOS数を解釈する際に、個人の病歴および生活習慣に基づく個別アプローチが重要であることを示唆している。

0 件のコメント:
コメントを投稿